Cáncer de próstata
Cáncer de próstata

Hola, hoy queremos destacar información sobre cáncer de próstata presentada en el congreso europeo de oncología ESMO 2024.
A continuación de compartimos 4 estudios muy interesantes.
- En cáncer de próstata castración resistente metastásico (CPCRm) el estudio PEACE3 evaluó el rol de enzalutamida sumada a RADIUM223 y el estudio SPLASH evaluó el tratamiento con 177Lu-PNT2002 en pacientes progresados a un ARPI.
- En cáncer de próstata sensible a la castración metastásico (CPSCm) el estudio ARANOTE evaluó el rol de la darolutamida sumada a la supresión androgénica y un subanálisis del estudio STAMPEDE evaluó el rol de la metformina agregada al tratamiento estándar.
- El agregado de enzalutamida a Radium223 demostró prolongar la supervivencia global (SG) en pacientes con CPCRm, los pacientes en la rama combinada lograron una SG de 42.2 m. vs. 35 m. en la rama monoterapia (HR: 0.69). El tratamiento con 177Lu-PNT2002 demostró disminuir en un 29 % el riesgo de progresión y muerte en pacientes seleccionados con CPCRm progresados a un ARPI (HR: 0.71).
- En pacientes con CPSCm el agregado de Darolutamida a la terapia de deprivación demostró una reducción de progresión y muerte del 46 % en la rama combinada (HR 0.54). Un subanálisis del estudio STAMPEDE evaluó el rol de la metformina agregada al tratamiento estándar en CPSCm sin demostrar un beneficio en SG en el total de los pacientes, aunque se demostró beneficio en todos los parámetros metabólicos y un beneficio en los pacientes de alto volumen, esto último requiere de mayor evaluación.
Radium-223 + enzalutamida en pacientes con cáncer de próstata resistente a la castración y enfermedad ósea exclusiva: primeros resultados del estudio EORTC-GUCG 1333/PEACE-3. PEACE-3)
El estudio PEACE 3 es un ensayo prospectivo de fase III que incluyó a pacientes con cáncer de próstata castración resistente metastásico (CPCRm) con lesiones óseas exclusivas y enfermedad asintomática o levemente sintomática. Los pacientes elegibles no habían recibido enzalutamida o Radium-223 previamente y no tenían metástasis viscerales conocidas. Se permitió el tratamiento previo con abiraterona y docetaxel en el contexto de enfermedad sensible a las hormonas. Los participantes del estudio se aleatorizaron 1:1 para el brazo experimental con Radio-223 55 kBq/kg por vía intravenosa cada 4 semanas durante 6 ciclos + enzalutamida 160 mg por vía oral una vez al día, y el brazo control con enzalutamida 160 mg por vía oral una vez al día.
El objetivo principal de este estudio fue la supervivencia sin progresión radiográfica, y los objetivos secundarios fueron la seguridad, la supervivencia global, el tiempo hasta el siguiente tratamiento, el tempo hasta la progresión del dolor, el tiempo hasta el primer evento esquelético sintomático.
Diseño del estudio

El uso de agentes de protección ósea fue mandatorio luego de una enmienda al protocolo tras observar el alto riesgo de fracturas en el estudio ERA-223 (https://doi.org/10.1200/jco.2015.33.15_suppl.tps508) . Este estudio incluyó 446 pacientes de 12 países, con una mediana de seguimiento del estudio de 42,2 meses. La mediana de edad de los pacientes fue de 70 años y la mediana de PSA fue de 23-25 ng/ml. Aproximadamente, el 30% de los pacientes habían recibido docetaxel previamente en el contexto de enfermedad sensible a la castración, y solo el 2-3% habían recibido abiraterona previamente.
El tratamiento combinado de Radio 223 más enzalutamida demostró un beneficio significativo en supervivencia libre de progresión radiográfica (mediana: 19,4 frente a 16,4 meses; HR: 0,69, IC del 95 %: 0,54-0,87, p = 0,0009). A los 24 meses, el 45 % de los pacientes del grupo de combinación con radio-223 no presentaron progresión radiográfica, en comparación con el 36 % de los pacientes del grupo de monoterapia con enzalutamida.
Objetivo principal: Supervivencia libre de progresión radiográfica.

La combinación también demostró un beneficio en la supervivencia global. La supervivencia global media fue de 42,3 meses frente a los 35 meses de la monoterapia con enzalutamida (HR: 0,69, IC del 95 %: 0,52-0,90, p = 0,0031). Si bien el valor p estuvo por debajo del umbral α preestablecido de 0,0034, hubo evidencia de riesgos no proporcionales (es decir, las curvas se cruzan durante el seguimiento inicial). Teniendo en cuenta esto y la falta de significancia inequívoca para el análisis de sensibilidad del tiempo de supervivencia medio restringido, el estudio continuará hasta el análisis final de la supervivencia global.
Objetivo secundario: Supervivencia global.

Se observaron eventos adversos relacionados con el fármaco de grado ≥3 en el 28% y el 19% de los pacientes en los grupos experimental y de control, respectivamente. En el 3 % y el 2 % de los pacientes se observaron muertes por eventos adversos, ninguno relacionado específicamente con los fármacos utilizados.
Eventos adversos

Como conclusión este estudio demostró ser positivo con un beneficio significativo de la adición de enzalutamida a 6 ciclos de Ra223 como tratamiento de primera línea para el cáncer de próstata metastásico resistente a la castración con lesiones óseas exclusivas. El análisis muestra un beneficio estadísticamente significativo en la supervivencia global que favorece a la combinación ENZ-RAD, y se hará un análisis final para confirmarlo.
Eficacia de 177Lu-PNT2002 en el cáncer de próstata metastásico resistente a PSMA tras progresión con un inhibidor de la vía del receptor de andrógenos: resultados del estudio SPLASH.
El tratamiento con 177Lu-PSMA-617 en el cáncer de próstata metastásico resistente a la castración que muestra captación de PSMA en estudios diagnósticos se ha evaluado previamente después de docetaxel +/- un inhibidor de la vía del receptor de andrógenos en el ensayo de fase 3 VISION (doi: 10.2967/jnumed.124.267816. Epub ahead of print. PMID: 39327018.) y TheraP (doi: 10.1111/bju.14876. Epub 2019 Oct 22. PMID: 31638341.)

El estudio PSMAfore (doi: 10.1016/S0140-6736(24)01653-2. Epub 2024 Sep 15. PMID: 39293462.) evaluó el rol del 177Lu-PSMA-617 en el contexto de cáncer de próstata metastásico resistente a la castración (CPRC) posterior a ARPI y sin tratamiento previo con taxanos, demostrando un beneficio en la supervivencia libre de progresión radiográfica, con datos en supervivencia global inmaduros.
El estudio SPLASH es un ensayo de fase 3 que incluyó a pacientes con diagnóstico de cáncer de próstata metastásico resistente a la castración con PSMA PET-positivo que progresaron con un ARPI y no recibieron quimioterapia para la enfermedad resistente a la castración. Los pacientes fueron aleatorizados 2:1 a 177Lu-PNT2002 (6,8 GBq IV cada 8 semanas hasta 4 ciclos) o ARPI alternativo. La edad media de los pacientes fue de 72 años y la mediana del PSA fue menor en el grupo experimental (13,2 frente a 19 ng/ml). Aproximadamente el 17 % de los pacientes habían recibido taxanos previamente para la enfermedad sensible a la castración y la mayoría de los pacientes (90 %) habían recibido la terapia ARPI previa en un estado M1.
Con una mediana de seguimiento de aproximadamente 12 meses, este ensayo cumplió su objetivo principal demostrando un beneficio de supervivencia libre de progresión radiográfica con 177Lu-PNT2002 (mediana: 9,5 frente a 6 meses; HR: 0,71, IC del 95 %: 0,55-0,92, p = 0,0088).
Objetivo principal: Supervivencia libre de progresión radiográfica.

El primer análisis no demostró un beneficio en supervivencia global para 177Lu-PNT2002 (mediana: 20,8 meses frente a no estimable; HR: 1,11, IC del 95 %: 0,73-1,69, p = 0,62).
El perfil de eventos adversos favoreció a 177Lu-PNT2002. Se observaron eventos de grado ≥3 en el 10% y el 12% de los pacientes en los brazos experimental y de control, respectivamente. No hubo eventos adversos relacionados con el tratamiento que provocaran la muerte. Se observaron eventos adversos relacionados con el tratamiento que provocaron la interrupción del tratamiento en el 2% y el 6% de los pacientes, respectivamente. Aquellos que provocaron una reducción del tratamiento del estudio se observaron en el 1% y el 5%, respectivamente.
Eventos adversos
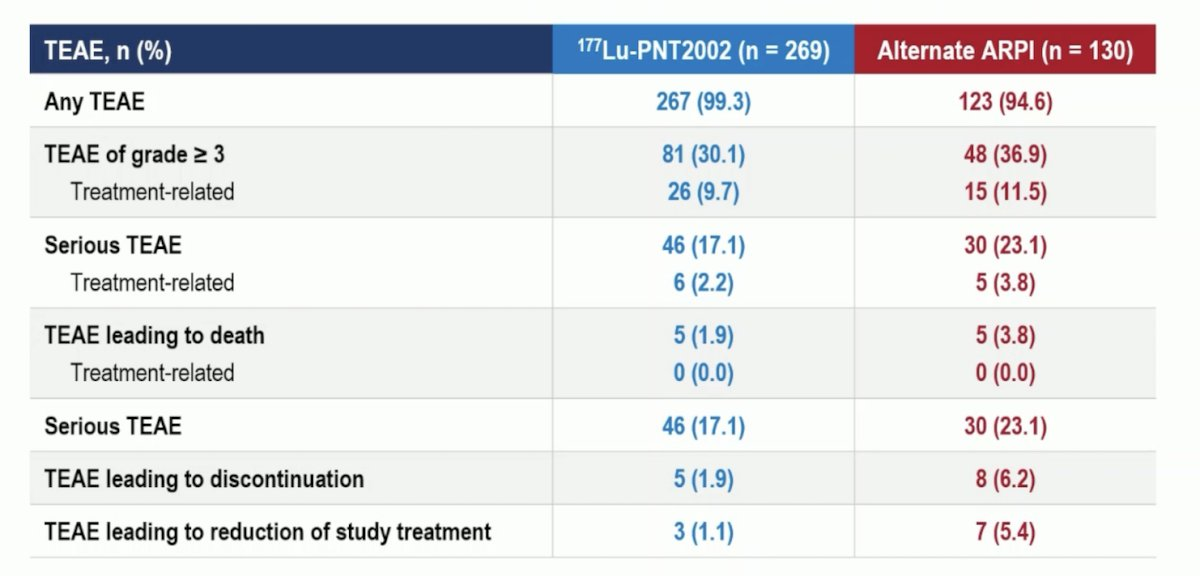
Los resultados del estudio concluyen que el 177Lu-PNT2002 fue bien tolerado y fue positivo para el objetivo principal del estudio. Los datos son inmaduros al momento para tener conclusiones sobre la supervivencia global.
Eficacia y seguridad de darolutamida más terapia de privación de andrógenos (TPA) en pacientes con cáncer de próstata metastásico sensible a hormonas (mHSPC) del ensayo de fase III ARANOTE.
La eficacia de Darolutamida más quimioterapia sumada a la terapia de deprivación androgenica (TDA) fue demostrada en el estudio ARASENS (doi: 10.1200/JCO.23.00041. Epub 2023 Feb 16. PMID: 36795843.). El estudio ARANOTE evaluó la eficacia de darolutamida agregada a la supresión androgénica versus la supresión androgénica en monoterapia en pacientes con cáncer de próstata sensible a la castración metastásico (CPSCm)
En el estudio se incluyeron pacientes con CPSCm que habían comenzado la supresión androgénica en un periodo ≤ a 12 semanas. Los pacientes fueron asignados aleatoriamente 2:1 a darolutamida 600 mg dos veces al día o placebo, cada uno con TDA.
El objetivo principal fue la supervivencia libre de progresión radiológica, y los objetivos secundarios la supervivencia global, el tiempo hasta el inicio a la terapia subsiguiente, el tiempo hasta la enfermedad castración resistente, el tiempo hasta la progresión del PSA y el tiempo hasta la progresión del dolor y la seguridad.
Diseño del estudio
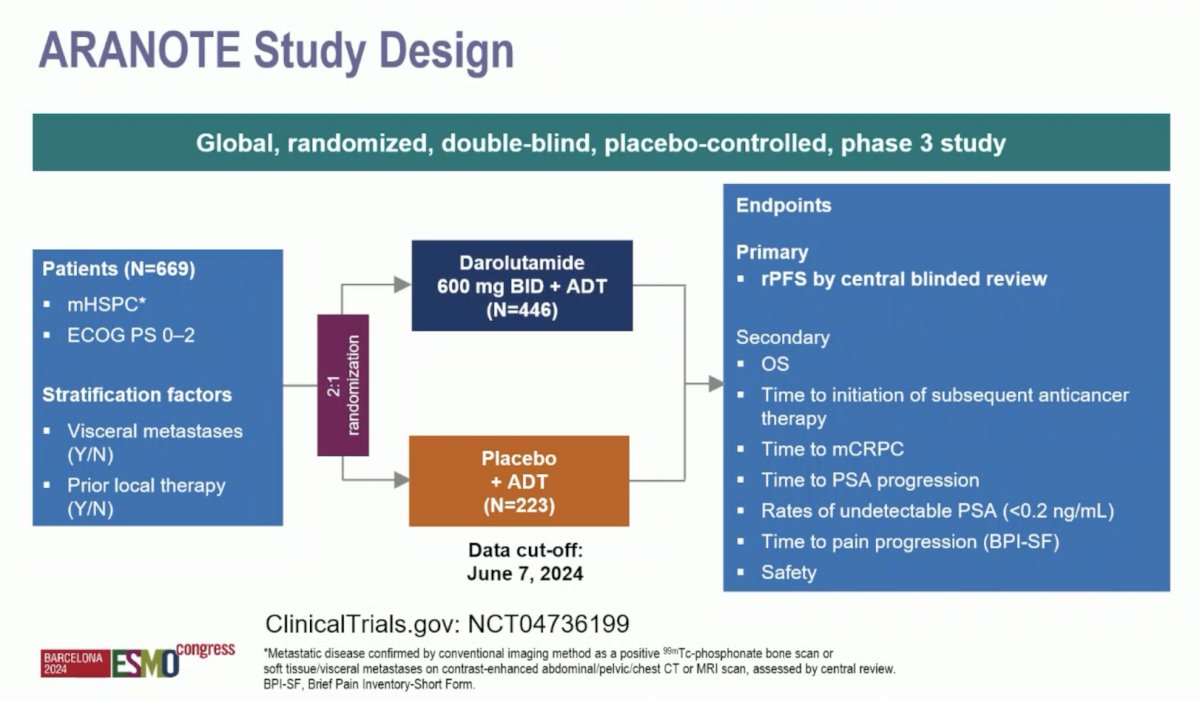
Se incluyeron 669 pacientes (darolutamida, n = 446; placebo, n = 223). La mediana de edad fue de 70 años, el 31 % eran asiáticos, el 9,7 % eran de raza negra, la mediana del PSA al inicio fue de 21,3 ng/mL y el 71 % tenía CPSCm de alto volumen.
El estudio fue positivo para su objetivo principal, donde darolutamida + TDA mejoró significativamente la supervivencia libre de progresión radiológica frente a placebo + TDA (HR 0,54, IC del 95 % 0,41-0,71).
Objetivo principal: Supervivencia libre de progresión radiográfica.

Este beneficio fue consistente en todos los subgrupos analizados, incluidos los pacientes con de alto y bajo volumen. El agregado de darolutamida demostró un beneficio en todos los objetivos secundarios del estudio.
Resultados de los objetivos secundarios del estudio.

La incidencia de eventos adversos secundarios al tratamiento fue bajas y similares entre los grupos, las interrupciones del tratamiento debido a eventos adversos fueron menores en los pacientes que recibieron darolutamida versus placebo (6,1 % vs 9,0 %).
Eventos adversos

Las conclusiones del estudio fueron que darolutamida más TDA demostró prolongar de forma significativa la supervivencia global sobre la TDA más placebo con una frecuencia de eventos adversos similar en los dos grupos.
Adición de metformina a la terapia de privación de andrógenos (TPA) para pacientes (pts) con cáncer de próstata metastásico sensible a hormonas (mHSPC): resultados de supervivencia general (SG) del ensayo de plataforma aleatorizado de múltiples brazos y múltiples etapas Rama K del estudio STAMPEDE.
Múltiples estudios intentaron demostrar el rol de la metformina dentro de la estrategia de tratamiento de los pacientes con cáncer de próstata. En el ensayo STAMPEDE, los pacientes no diabéticos con cáncer de próstata sensible a la castración metastásico fueron asignados aleatoriamente 1:1 a tratamiento estándar o tratamiento estándar + metformina. El tratamiento estándar incluyó TDA ± radioterapia ± docetaxel ± inhibidor de la vía del receptor de andrógenos. El objetivo primario del estudio fue la supervivencia global.
Diseño del estudio

El estudio incluyó 1.874 pacientes con una edad media de 69 años (rango 63-73), una mediana de PSA de 84 ng/ml (rango 24-352) y enfermedad metastásica de novo en 1.758 (94 %) pacientes frente 116 (6 %) con enfermedad recurrente. Se planificó que el tratamiento estándar seria que el 82 % de los pacientes recibieran docetaxel y el 3 % recibieran un inhibidor de la vía del receptor de andrógenos.
Después de una mediana de seguimiento de 60 meses, el HR para la supervivencia global entre los grupos fue de 0,91 (IC del 95%: 0,80-1,03; p = 0,148). La supervivencia global media fue de 63,1 (IC del 95%: 57,6-68,7) y 69,1 (IC del 95%: 62,7-73,2) meses en los grupos de atención estándar y atención estándar + metformina.
Supervivencia global

En pacientes con enfermedad de alto volumen versus bajo volumen (definición CHAARTED), la HR fue 0,79 (IC del 95 % 0,66-0,93; p = 0,006) y 1,00 (IC del 95 % 0,79-1,26; p = 0,992), respectivamente, con un valor p de interacción de 0,086.
Supervivencia global en pacientes de bajo y alto volumen.

Todos los parámetros metabólicos mejoraron con el tratamiento de metformina, incluyendo la reducción de peso (-2,5; IC del 95 %: -3,6 al -1,4), la glucosa en ayunas (-0,17; IC del 95 %: -0,29 al -0,05) y la HbA1c (-1,0; IC del 95 %: -1,6 al -0,5). Además, el grupo de metformina disminuyó el colesterol total (-0,16; IC del 95 %: -0,29 a -0,03) y el colesterol LDL (-0,17; IC del 95 %: -0,29 al -0,05).
Se notificaron eventos adversos ≥ grado 3 en el 52 % y el 57 % en los grupos de atención estándar y atención estándar + metformina, respectivamente. Los eventos adversos gastrointestinales aumentaron con metformina.
Las conclusiones del estudio fueron que de acuerdo con los resultados la metformina no mejora la supervivencia global en pacientes metastásicos no seleccionados, pero puede mejorar los resultados del cáncer y la supervivencia en pacientes con alto volumen de enfermedad. Los parámetros metabólicos mejoraron significativamente.
